当前针对睾丸衰老的治疗方法并不理想
随着全球老龄化进展加速以及国内人口负增长,各种衰老相关慢性疾病以及两性生育力保护日益引起重视。睾丸衰老(testicular aging)是指睾丸结构和功能随着年龄增长逐渐衰退的过程,主要特点是睾酮合成能力以及生精功能逐渐下降,不仅影响男性生育力和生育质量,而且影响整体健康状况。尽管关于睾丸衰老的命名与诊疗标准仍存在争议,但相较迟发性性腺功能减退症(late-onset hypogonadism,LOH),睾丸衰老更准确地概括了在衰老过程多因素作用下睾丸生精及内分泌功能发生的渐进改变与多器官系统效应。因此,延缓睾丸衰老对于改善中老年男性健康和生活质量至关重要。
目前睾丸衰老的治疗策略主要包括内分泌调节和抗氧化疗法等,但有效性和安全性有待进一步验证。现阶段临床上主要通过直接补充外源性雄激素(睾酮),缓解睾酮水平低下相关的临床症状,称为睾酮替代疗法(testosterone replacement therapy,TRT)。TRT可提高血清睾酮水平,改善男性性功能、肌力、代谢、骨密度等情况,但仍存在诸多缺陷。
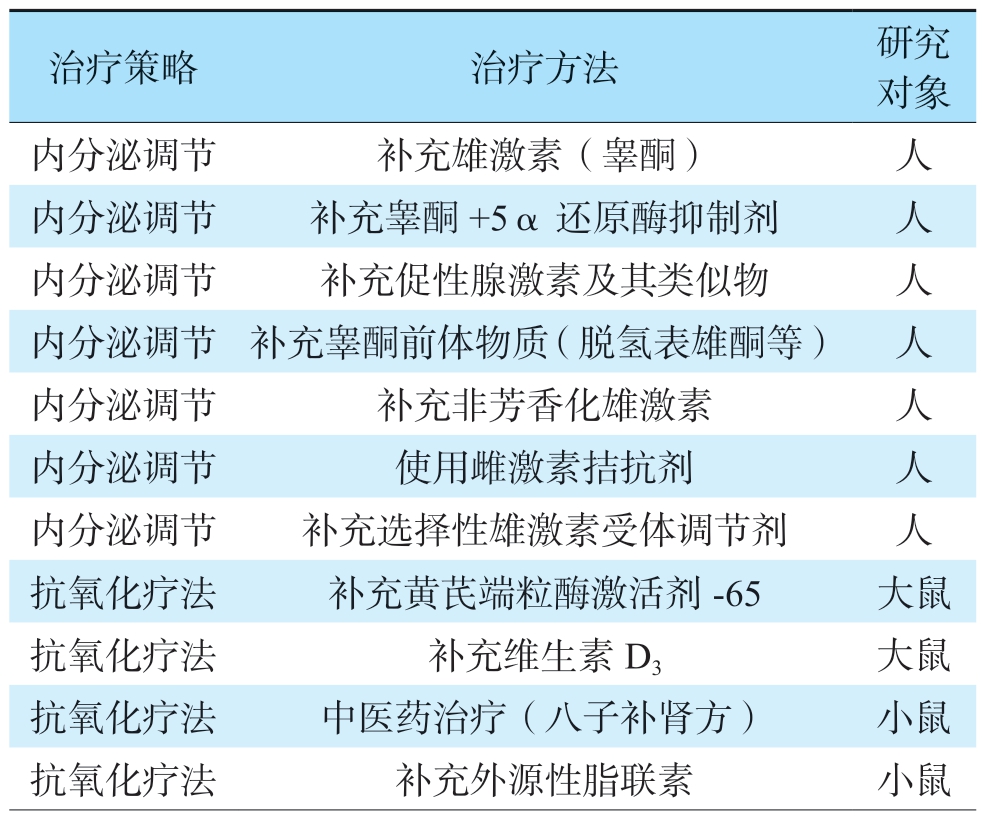
睾丸衰老的内分泌及抗氧化治疗策略
一方面,睾丸不仅可分泌睾酮,还可分泌胰岛素样因子(insulin-like factor,INSL)3 和抗苗勒管激素等多种激素,进而调控骨代谢和血管发育等过程。血清睾酮水平下降是睾丸衰老的表现而非原因,因此单纯补充睾酮无法替代睾丸复杂的内分泌功能,更无法延缓睾丸衰老。另一方面,睾酮分泌受到下丘脑-垂体-睾丸轴的精密调控。直接补充外源性睾酮会反馈性抑制LC的分泌功能,导致内源性睾酮分泌不足,恶化患者的生精功能。此外,TRT还可能加重患者的下尿路梗阻症状,增加红细胞增多症和前列腺癌等的发生率。
而干细胞作为治疗睾丸衰老的新策略具有广阔应用前景
干细胞是具有强大的自我更新能力和多向分化潜能的细胞群体。自从实现胚胎干细胞分离与体外诱导多能干细胞以来,干细胞的基础与临床应用研究不断深化,推动了细胞疗法的发展。干细胞移植是将干细胞或其衍生物通过特殊技术移植到体内以重建损伤部位和恢复生理功能的细胞疗法,目前已被用于治疗皮肤、骨关节、神经、血液及内分泌相关疾病,并在衰老与再生医学领域受到广泛关注。
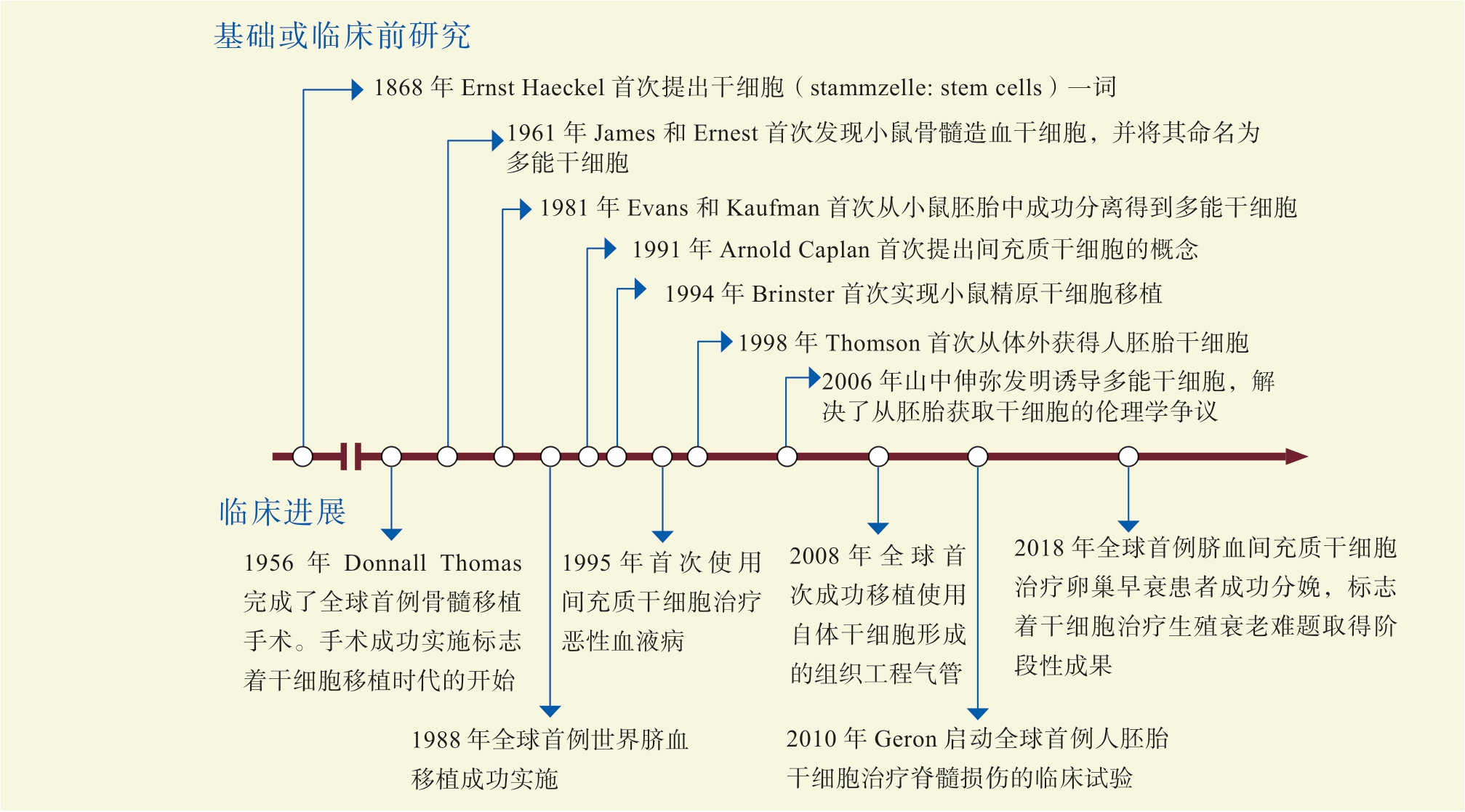
干细胞移植研究历程的重要进展
而干细胞移植可通过定向分化替代衰老细胞,还可通过免疫调节维持组织微环境稳态,作为治疗睾丸衰老的新策略具有极大潜力。近年来,干细胞移植治疗睾丸衰老的研究取得令人兴奋的成果。随着基因工程和生物材料等技术的蓬勃发展,诸如理化因子预处理、基因修饰及结合仿生材料等新兴疗效优化策略也被广泛探讨。
目前干细胞移植治疗睾丸衰老的研究主要集中在恢复睾丸生精功能和改善睾酮分泌两个方面。
干细胞移植促进生精功能恢复
干细胞来源广泛、种类繁多,围绕恢复生精功能的干细胞研究主要包括精原干细胞(spermatogonial stem cell,SSC)、睾丸间质干细胞(stem Leydig cell,SLC)和MSC。
精原干细胞移植促进生精功能恢复。SSC是位于睾丸生精小管基底膜上的成体干细胞,是维持精子发生和男性生育力的基础。生理状态下,SSC能够自我更新以维持干细胞库的稳定,也可通过分化产生成熟精子。SSC移植疗法,即分离患者的自体SSC,经体外培养扩增后移植到患者的输出小管、生精小管或睾丸网(rete testis),理论上可以补充精子发生的“种子”来源,恢复损伤或衰老睾丸的生精功能。Brinster等最早在不育小鼠中通过SSC 移植成功恢复精子发生并产生存活后代,证实了同种异体SSC移植后分化产生功能精子和恢复生育力的可行性。随后,SSC移植在其他哺乳动物的研究中得到了广泛探索,包括大鼠、犬、猪、牛、食蟹猴等。
睾丸间质干细胞移植促进生精功能恢复。SLC是位于睾丸生精小管及血管周围间隙的组织特异性成体干细胞,可定向分化为LC。LC既是睾丸内分泌细胞,也是生精微环境的重要组成部分,因为生理状态下睾丸的生精功能和睾酮合成功能并非完全独立的两个过程,生理浓度的睾酮对于维持正常的精子发生起着重要作用。SLC的自我更新与定向分化有助于维持睾丸间质微环境中LC的健康状态,在睾丸损伤修复反应中发挥重要作用,为“种子”的重新萌发提供良好的“土壤”环境。
间充质干细胞移植促进生精功能恢复。MSC是广泛来源于多种组织(骨髓、脂肪、脐带、胎盘、牙髓等)的多能干细胞,具有对组织微环境独特的感知与调控功能。随着衰老过程不断积累损伤因素,生精细胞的凋亡比例逐渐增加。MSC可能主要通过减少生精细胞凋亡和减少氧化应激以促进生精功能的恢复。Hsiao等研究表明小鼠睾丸原位注射脂肪组织来源的MSC能够明显减少生精细胞的凋亡,进而改善精子质量。Sherif 等研究发现小鼠静脉注射骨髓来源的MSC不仅能够缓解顺铂诱导的睾丸毒性以及睾丸氧化应激,同时可降低睾丸局部炎症因子水平,进而恢复生精,提示MSC移植在促进生精方面具有巨大潜力。
干细胞移植促进睾酮合成分泌
通过移植干细胞定向分化为LC以改善睾酮合成功能具有极大的应用潜力,目前成功实现Leydig样细胞定向分化的干细胞类型包括成体SLC、MSC和诱导多能干细胞(induced pluripotent stem cell,iPSC)。
睾丸间质干细胞移植促进睾酮合成分泌,目前认为SLC移植是针对睾酮分泌减少或LOH的细胞治疗首选方案。
间充质干细胞移植促进睾酮合成分泌,2021年,Nguyen等报道了关于静脉输注自体脂肪来源MSC的临床Ⅰ/Ⅱa期试验,该研究发现MSC移植后患者的睾酮水平显著提高,并在6个月内保持高水平,在12个月后才出现下降,同时患者的性生活满意度也明显增加。这些研究提示MSC可能通过旁分泌细胞因子或系统免疫调控的作用恢复LC功能,表明MSC在恢复睾酮分泌方面具有巨大的潜力。
诱导多能干细胞移植促进睾酮合成分泌iPSC是通过导入特定转录因子将终末分化的体细胞重编程形成的多能干细胞,因其来源方便及分化潜能高成为了体外诱导分化获取LC的替代选择。2019年,Li 等和Chen等分别报道了基于病毒转染处理和基于小分子化合物预处理策略在体外获取人类iPSC衍生的Leydig样细胞,并进一步证明了iPSC分化的Leydig样细胞移植到大鼠体内后可恢复血清睾酮水平和增加睾丸重量。
高产的稻田不仅需要优良的种子,还需要肥沃的土壤。如何提高干细胞移植治疗睾丸衰老的效果,不仅需要关注干细胞的类型、数量、递送方式,还需要关注移植干细胞在睾丸生态位的相互作用及存活状态。
来源:《器官移植》2023年
免责声明:本文内容仅作为健康信息分享,不构成任何医疗建议,不用于任何商业用途。如有侵权,请联系删除。
