间充质干细胞是再生医学和免疫调节中干细胞疗法的关键参与者
间充质干细胞(mesenchymal stem cell, MSC)是一种多能干细胞,具有干细胞的所有共性,即自我更新和多向分化能力。在临床应用也最多,与造血干细胞联合应用,可以提高移植的成功率,加速造血重建。由于间充质干细胞分化的组织类型十分广泛,因此临床应用价值不菲。
MSC是再生医学和免疫调节中干细胞疗法的关键参与者。它们可以从多种组织中分离出来,如骨髓、脂肪组织、胎儿组织、经血和大多数类型的间叶组织。MSC是多能非造血细胞,能够分化为多种细胞类型,包括肌细胞、骨细胞和脂肪细胞。由于MSC的安全性、非免疫原性的特点和巨大的治疗潜力,MSC移植作为创新性药物对ALI/ARDS(急性肺损伤/ 急性呼吸窘迫综合征)等多种病症的治疗效果已在广泛研究中。
间充质干细胞移植治疗病毒感染引起的ARDS优势显著
ARDS(急性呼吸窘迫综合征)是以进行性的动脉血氧不足和呼吸困难为主要特征,表现为严重的急性肺损伤,甚至可能导致多器官功能衰竭。因为缺乏保护肺通气功能的特异性药物,ARDS的治疗在临床上仍是一个巨大挑战。多项研究表明,多种病毒感染后均可导致暴发性肺炎和ARDS,如严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)和H7N9病毒。
MSC可以减少ARDS患者促炎性细胞因子的产生,并通过旁分泌释放大量可溶性因子【如血管内皮生长因子(vascular endothelial growth factor, VEGF)和转化生长因子-β1(transforming growth factor-β1, TGF-β1)】,进而促进肺组织的再生和修复。
在ARDS动物模型中,MSC可以保护血管内皮和肺泡上皮屏障功能。此外,MSC可以增强肺泡液清除率并增加宿主免疫细胞的吞噬活性,从而提高抗菌效果。MSC治疗ARDS的潜在机制如下图所示。
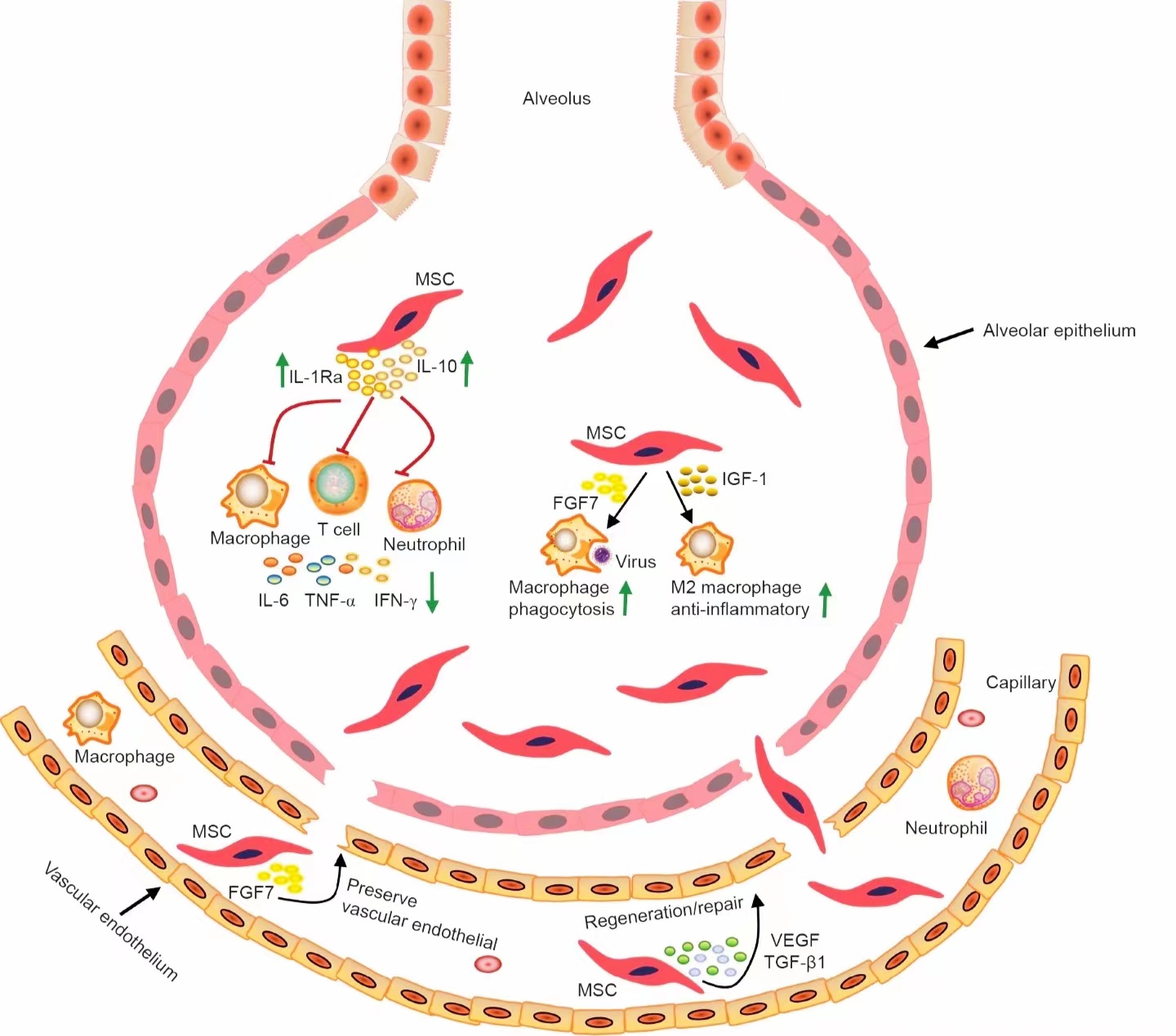
MSC治疗ARDS的潜在机制。
间充质干细胞通过不同机制发挥治疗ARDS的作用。MSC可分泌IL-10、IL-1受体拮抗剂(Ra)、成纤维细胞生长因子7(FGF7)、胰岛素样生长因子1(IGF1)、VEGF、TGF-β1等多种因子,减少IL-6、肿瘤坏死因子(TNF)-α、IFN-γ等促炎细胞因子的产生,提高巨噬细胞活性。一旦被招募和(或)诱捕到局部微循环和(或)肺血管系统,局部细胞(包括内皮细胞和局部招募的炎症细胞)释放的激活因子能够刺激间充质干细胞释放各种旁分泌介质,增强其再生和修复受损肺组织的能力。T细胞:T淋巴细胞;M2巨噬细胞:交替活化巨噬细胞。
在治疗ARDS的临床实践中已证明,MSC与其他免疫抑制剂(如高成本的单克隆抗体类药物或不良反应较多的糖皮质激素药物)相比具有相当大的优势。这些优势包括可用性、易于培养获取、具有多向分化潜能且安全性好,无发生恶性肿瘤的可能。
间充质干细胞为COVID-19相关ARDS的治疗提供了新思路
研究人员最近发表的一项临床研究结果显示,同种异体经血来源的间充质干细胞(mesenchymal stem cell, MSC)移植能够显著降低甲型流感病毒(influenza A, H7N9)感染引起的急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的死亡率,并且没有相关严重不良反应发生。这项研究可能为新冠病毒肺炎(Coronavirus Disease 2019, COVID-19)相关ARDS的治疗提供一个新的思路。
在研究中,MSC移植组患者的死亡率与对照组相比显著降低(17.6% vs. 54.5%),并且在中至重度H7N9感染诱发ARDS的患者中未发现MSC输注相关的毒性或严重的不良事件。在随访的五年中,计算机断层扫描检查发现MSC移植改善了包括线性纤维化、支气管扩张和孤立的胸膜增厚区域等影像学变化;此外在长期的随访中也未发现MSC输注引起的不良反应。
未来,间充质干细胞或将是治疗病毒感染引起急性呼吸窘迫综合征的一种有前景的治疗策略。
来源:2020年《工程(英文)》
北京清美联创干细胞科技有限公司致力于多种干细胞临床应用研究,人体冷冻、核辐射防治等技术研发。
目前已拥有67种不同功能的专能细胞如神经干细胞、胰腺干细胞、卵巢干细胞、肝脏干细胞、心肌细胞、毛囊干细胞等的制备技术。
北京清美联创干细胞科技有限公司服务咨询与技术合作电话:010-88292706。
